Reduktion
Die Reduktion ist die Aufnahme von Elektronen, was eine Erniedrigung der Oxidationszahl zur Folge hat. Es ist der Entzug von Sauerstoff aus einem Oxid. Zur Reduktion ist meist ein Reduktionsmittel notwendig; das ist ein Stoff, der den Sauerstoff aufnimmt, also selbst oxidiert wird. Ausnahme: Oxide edler Metalle benötigen kein Reduktionsmittel, hier genügt die bloße Erhitzung.
Beispiel:
Oxidationsmittel wird reduziert
------------------>
CuO + H2 ----->Cu + H2O
----------------->
Reduktionsmittel wird oxidiert.
Reduktionsmittel
Reduktionsmittel sind Elektronendonatoren, die bei der Reaktion mit einem Partner oxidiert werden. Das Reduktionsmittel zwingt seinen Partner Elektronen aufzunehmen.

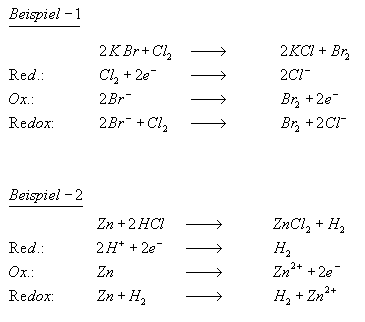
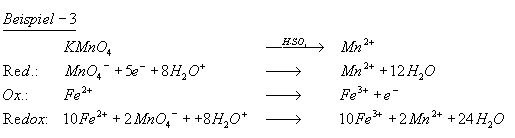
5/2005
Autor: Peter Rauch
Lexikon Catalog-Web | Marktplatz der Ideen | Kontakt | AGB/Datenschutzerklärung 12/2017